細胞の中央代謝はエネルギー代謝としても知られており、生体の細胞内においてエネルギー恒常性を維持しバイオマスを作り出すための生化学的ネットワークを形成している1。細胞の代謝を研究することで、特定の組織の機能について理解し、新規の治療法を開発し、細胞療法の応用につながる知見を得られることが期待されている。
代謝は、組織、細胞系列、分化状態に応じて柔軟に変化する2,3,4。従って、基礎研究や細胞を用いた治療法の開発に際しては、慎重に代謝解析を行う必要がある。全ての代謝経路が細胞の機能に関わっているが、特に解糖系は、免疫細胞を正常に保つ役割と、腫瘍の増殖における役割という、異なる二つの役割が認められている1,5,6。また、解糖系は細胞の増殖や分化において主要な代謝中間体の産生にも関与しており、細胞の運命や機能を同定する際も重要な役割を担っている7,8,9。
通常、解糖系は効率的かつ制御された状況でグルコースをピルビン酸へと異化し、その過程においてアデノシン三リン酸(ATP)と還元型のニコチンアミドアデニンジヌクレオチド(NADH)が産生される10,11。
その際に、ミトコンドリア代謝、特に酸化的リン酸化(OXPHOS)は、ATP不足を解消する役割を果たしている。
十分に酸素が存在する環境下の解糖系では、乳酸脱水素酵素(LDH)によって少量ながら定量可能な濃度の乳酸が産生される。
一方でがんにおいては、好気的解糖系が亢進し、急速な細胞増殖や乳酸産生の増加につながる1,6。この現象はWarburg効果と呼ばれており、腫瘍細胞に特徴的な代謝プロファイルとなっている。
代謝中間体は、重要な細胞間シグナル伝達分子としても機能する12,13,14。そのため、細胞の微小環境の研究は、バイオ医療の研究とも関連している。免疫応答においては、解糖系が活性化T細胞のエフェクター機能を亢進させるが、乳酸が存在する微小環境ではその活性が抑制される場合もある8,13,14。ライブセルの代謝解析では、特定の腫瘍微小環境(TME)と腫瘍の細胞療法の有効性の両方について、有用な知見を得ることが可能である15。
本稿では、がん免疫研究におけるライブセルの代謝解析の重要な役割について概説する。また、細胞療法の研究におけるリアルタイムのモニタリングの利点と対比しつつ、従来のサンプリングベースの測定方法の短所についても検討する。
がん免疫研究における代謝
代謝研究は、免疫細胞療法開発の中心に位置づけられている。実際に、がん免疫研究を含む免疫学におけるその役割は、近年注目度を増している16,17,18。がん免疫研究では、がん治療に向けて獲得免疫系の応用に焦点を当てている19。特に、キメラ抗原受容体T細胞(CAR-T細胞)の技術は、主要な研究対象となっており、基礎研究と臨床の両方において効果が大いに期待されている。
CAR-T細胞は、その細胞表面に「キメラ抗原受容体(CAR)」と呼ばれる特殊な受容体を発現するように設計されている。これらの受容体はがん抗原を標的として、正常な組織の損傷を招くことなくがん細胞を認識して攻撃する。その際に代謝活性はCAR-T細胞の適合性と機能の主要な指標となる5,18。実際に、全てのT細胞は、分化して成熟するにつれて大幅な代謝リプログラミングが起こり、エフェクター機能を強化するために、静止状態から高いエネルギー状態へと移行する(図1)。
ナイーブT細胞(TN)や休止期のT細胞は、定常の代謝状態で血液中を循環する20。相補的ながん抗原に遭遇すると、PI3K-AKTmTORシグナル伝達経路が活性化され、解糖系を亢進させる転写因子が発現する20,21。解糖系が亢進したTNはエフェクターT細胞(TEFF)に分化し、免疫機能を発揮することが可能である。一旦抗原提示細胞が除去されると、TEFFの解糖系の比率が減少する。これは少ないながらもかなりの数のTEFFを刺激して、十分に分化したメモリーT細胞(TM)として長期間体内に存在する。TMとTN は解糖系のプロファイルは類似しているが、TMはミトコンドリア呼吸鎖の比率が高いため、同じ抗原に遭遇した際には迅速に再活性化することができる。もし分化する過程において代謝パラメータが条件に満たない場合には、T細胞は分化能を失ったり、抗腫瘍免疫応答を十分に発揮できなくなる場合がある22,23,24。
養子細胞免疫療法を最適化する
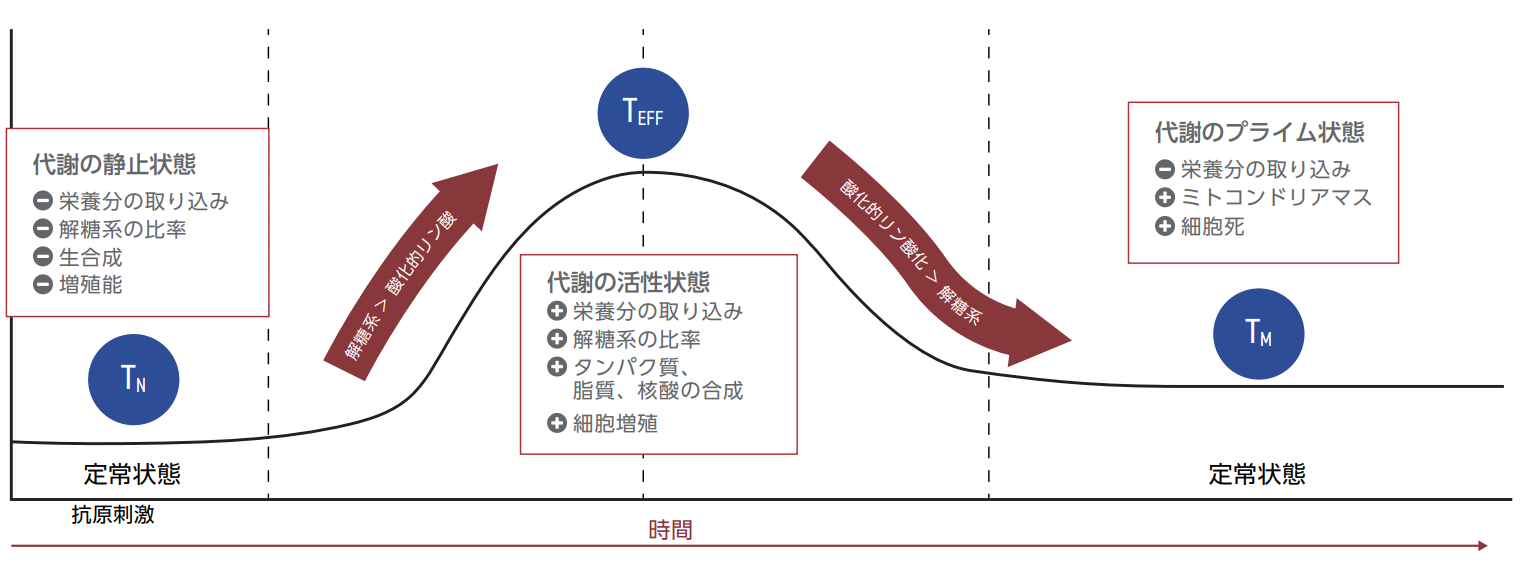
図1:活性状態および静止状態におけるT細胞の代謝20。
CAR-T細胞の代謝活性をリアルタイムで解析することで、TEFF活性化の理解を促進し、最適な治療の設計を支援することができる14,21,25,26。また、特定の腫瘍に対する有効性や持続性、併用療法における有効性の向上につながる可能性もある27,28。例えば、特定の共刺激受容体を発現するCAR-T細胞は、他の細胞種よりも効果的にリンパ腫を攻撃する代謝特性を持つことがわかっている27。
さらに、CARが持つ共受容体に別の受容体を組み合わせることで、CAR-T細胞の代謝特性に影響して低分化のTEFF表現型に寄与する可能性があり、in vivoの研究で高い有効性を示している29。
代謝を正確に理解することで、特定の共刺激効果が解明され、治療効果の高いCAR-T細胞の開発が可能になった。
さらに、CAR-T細胞への刺激によって誘導された解糖系の転写因子が高発現することで、TME におけるCAR-T細胞の持続性を助け、乳酸による免疫抑制の影響を低減することも可能である15。また、解糖系以外の経路の比率を高めることによってCAR-T細胞の疲弊を防ぐことができ、治療効果の持続性を高められる30。
こうした研究で応用範囲を広げるためにも、正確な代謝解析が重要である。
がん免疫療法は、多くの場合、併用療法あるいは多剤併用療法の一部として行われる31,32。
併用療法は、固形腫瘍の治療において注目されている分野である33,34。プログラム細胞死タンパク質1(PD-1)は抑制性受容体で、これは抗腫瘍治療において広く標的とされてきた35。PD-1はさまざまな種類の免疫細胞の表面に存在し、腫瘍細胞の表面上にある相補的なリガンドと相互作用して、腫瘍の免疫逃避メカニズムを可能にする28,35。
PD-1刺激はCAR-T細胞の解糖系比率も抑制することが可能で、ミトコンドリア呼吸鎖への代謝シフトにつながる可能性もある35。
このように、代謝解析によって、より効果的なCAR-T細胞作製が可能となり、免疫逃避に直面した際には、PD-1阻害剤を併用しつつ治療の持続性をはかることができると期待される。
細胞の代謝解析における課題と可能性
がん免疫研究では、現在いくつかの代謝解析方法が存在している。
最新の技術では、プローブを利用した測定方法によって、培養上清の主要な代謝パラメータ(酸素消費、細胞外酸性化度、代謝産物濃度の変化)を測定する。この方法では細胞のエネルギー恒常性に関するリアルタイムの知見が得られるが、従来のサンプリングベースの測定では解糖系の精緻な変化に関するデータを取得できないおそれがある。
乳酸産生速度は、解糖系の活性を測定できる1つのパラメータである(図2)36。
また、他の代謝経路のバランスの変化を評価するために用いることも可能である。
しかし、この重要な代謝産物である乳酸の産生速度が速いということは、サンプリングベースの方法では解糖系の機能を過小評価しやすいことを意味している37。
その上、CAR-T細胞の代謝は非常に柔軟な性質を持っており、急速な変化は見逃されやすくなる4,5。リアルタイム測定は、細胞や培地を過度にかく乱することもなく、サンプリングベースの方法よりも優れた精度を実現できると考えられる。
グルコース消費と乳酸産生を測定することで、ATP合成を推測して代謝フラックスを解析する際も、より直接的な手段をとることができる。従って、入念な実験計画に基づいたリアルタイム測定により、異常値や不正確な結果によってデータ解釈を誤るリスクを低減し、簡便かつ明確にTEFF活性化を解析することが期待される。
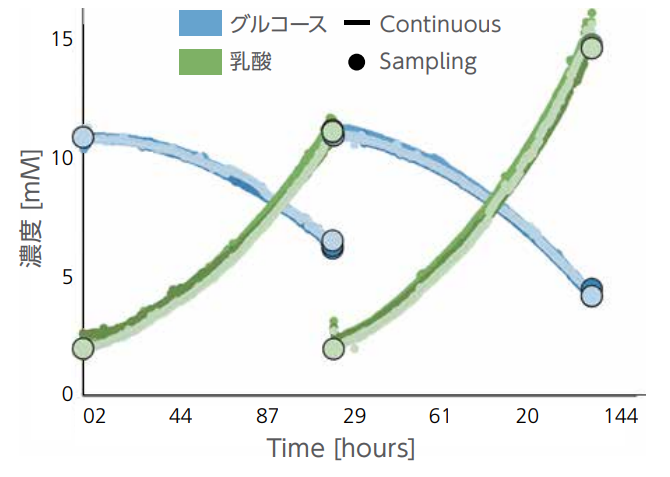
図2:最新のライブセルの代謝解析技術による、グルコースと乳酸のリアルタイム測定と
サンプリングによる測定の結果の比較38。
ライブセル分析装置の登場によりin vitro研究の範囲は大幅に拡大したが、その多くで、専用の培地や再播種が求められたり、測定環境に合わせた作業など複雑な細胞培養の条件が求められる。こうした条件は、時間と資源の面でコストがかさみ、細胞に想定外の影響を及ぼしたり、細胞の管理が煩雑になるおそれもある。そのため、過度の処理を必要とせず標準的な培養容器を用いてリアルタイム測定を行う分析装置のプロトコルは、より信頼性の高い研究手法であると考えられる。また、それらは、既存の研究室のシステムや機器との互換性も良好で、導入費用を抑えつつ、培養が困難な細胞や、非接着性の細胞についての研究にも適用される可能性がある。
ライブセル代謝分析の最新技術は、標準的な培養環境にある細胞の代謝状態をリアルタイムで測定することを目的としている(図2)。また、他の方法よりも一貫性、柔軟性、再現性が高く、他の確認実験と直接比較できるデータを得られることが期待されている。
技術的進歩を実現するためには、リアルタイム代謝データの正確さと安定性が重要である。リアルタイムのモニタリングは、異常な結果を排除しやすくなるだけでなく、CAR-T細胞の代謝リプログラミングについて、得難い知見も得る可能性がある38。実験の際には、共受容体により遺伝子工学的に引き起こされた代謝への影響を経時的に測定する方が適切である場合があるが、その際、CAR-T細胞の分化や持続性の変化をリアルタイムで明らかにすることができる15,31,39,40。
これらのデータを活用することで、さらなる解析や臨床応用に適した細胞集団を見極めるのに役立つと考えられる。リアルタイムのモニタリングは、代謝変化を経時的に観測することを可能にし、改変したCARによって細胞がin vitroでどのように分化し成熟するのか確認する上でも大いに貢献すると考えられる38,40。
結論と将来展望
リアルタイムの代謝解析はがん免疫研究の重要な分野であり、さらに高度で適切な細胞療法の開発につながると期待される。細胞療法の有効性を最適化する際も、免疫細胞の代謝を理解することが重要である。さらに代謝解析によって、TMEが免疫細胞に与える影響や、in vivoへの応用時に直面する可能性のある問題点についての理解を深めることができる可能性がある。代謝解析を行うことで、CAR-T細胞の活性と機能に関する洞察が得られ、細胞工学的操作の指標となり、治療成績を向上できる可能性がある。
しかし、そのような技術においては将来的に、細胞の代謝データの信頼性、安定性、論文発表の可能性を高めるために、リアルタイムのモニタリングアプローチの応用に焦点を当てる可能性が高いと考えられる。この理由から、リアルタイムのモニタリングは、がん免疫の分野に大きな影響を及ぼす、代謝研究のゴールド・スタンダードになることが期待される。
参考文献
- Pavlova NN, Zhu J, Thompson CB. The hallmarks of cancer metabolism: Still emerging. Cell Metab. 2022;34(3):355-377.
doi:10.1016/j.cmet.2022.01.007
- Wang Z, Ying Z, Bosy-Westphal A, et al. Specific metabolic rates of major organs and tissues across adulthood: evaluation by mechanistic model of resting energy expenditure. Am J Clin Nutr. 2010;92(6):1369-1377.
doi:10.3945/ajcn.2010.29885
- Gebert N, Rahman S, Lewis CA, et al. Identifying celltype-specific metabolic signatures using transcriptomeand proteome analyses. Curr Protoc. 2021;1(9):e245.
doi:10.1002/cpz1.245
- Peng M, Li MO. Metabolism along the life journey of T cells. Life Metab. 2023;2(1):load002.
doi:10.1093/lifemeta/load002
- DePeaux K, Delgoffe GM. Metabolic barriers to cancer immunotherapy. Nat Rev Immunol. 2021;21(12):785-797.
doi:10.1038/s41577-021-00541-y
- de la Cruz-López KG, Castro-Muñoz LJ, Reyes-Hernández DO, García-Carrancá A, Manzo-Merino J.Lactate in the Regulation of Tumor Microenvironment and Therapeutic Approaches. Front Oncol. 2019;9:1143.
doi:10.3389/fonc.2019.01143
- Ediriweera MK, Jayasena S. The Role of Reprogrammed Glucose Metabolism in Cancer. Metabolites.2023;13(3):345.
doi:10.3390/metabo13030345
- Hortová-Kohoutková M, Lázničková P, Frič J. How immune-cell fate and function are determined bymetabolic pathway choice: The bioenergetics underlying the immune response. Bioessays. 2021;43(2):e2000067.
doi:10.1002/bies.202000067
- Chi H. Immunometabolism at the intersection of metabolic signaling, cell fate, and systems immunology.Cell Mol Immunol. 2022;19(3):299-302.
doi:10.1038/s41423-022-00840-x
- Naifeh J, Dimri M, Varacallo M. Biochemistry, Aerobic Glycolysis. In: StatPearls. Treasure Island (FL): StatPearlsPublishing; 2023. https://www.ncbi.nlm.nih.gov/books/NBK470170/. Accessed November 01, 2023.
- Jones W, Bianchi K. Aerobic glycolysis: beyond proliferation. Front Immunol. 2015;6:227.
doi:10.3389/fimmu.2015.00227
- Haas R, Cucchi D, Smith J, Pucino V, Macdougall CE, Mauro C. Intermediates of Metabolism: FromBystanders to Signalling Molecules. Trends Biochem Sci.2016;41(5):460-471.
doi:10.1016/j.tibs.2016.02.003
- Fischer K, Hoffmann P, Voelkl S, et al. Inhibitory effect of tumor cell-derived lactic acid on human T cells. Blood. 2007;109(9):3812-3819.
doi:10.1182/blood-2006-07-035972
- Rostamian H, Khakpoor-Koosheh M, Jafarzadeh L,et al. Restricting tumor lactic acid metabolism using dichloroacetate improves T cell functions. BMC Cancer.2022;22(1):39.
doi:10.1186/s12885-021-09151-2
- Mangal JL, Handlos JL, Esrafili A, et al. Engineering Metabolism of Chimeric Antigen Receptor (CAR) Cells for Developing Efficient Immunotherapies. Cancers (Basel).2021;13(5):1123.
doi:10.3390/cancers13051123 - Pajai S, John JE, Tripathi SC. Targeting immune-oncometabolism for precision cancer therapy. Front Oncol.2023;13:1124715.
doi:10.3389/fonc.2023.1124715
- Bader JE, Voss K, Rathmell JC. Targeting Metabolism to Improve the Tumor Microenvironment for Cancer Immunotherapy. Mol Cell. 2020;78(6):1019-1033.
- Leone RD, Powell JD. Fueling the Revolution: Targeting Metabolism to Enhance Immunotherapy. Cancer Immunol Res. 2021;9(3):255-260.
doi:10.1158/2326-6066.CIR-20-0791
- Liu C, Yang M, Zhang D, Chen M, Zhu D. Clinical cancer immunotherapy: Current progress and prospects. Front Immunol. 2022;13:961805.
doi:10.3389/fimmu.2022.961805
- Pearce EL, Poffenberger MC, Chang CH, Jones RG. Fueling immunity: insights into metabolism andlymphocyte function. Science. 2013;342(6155):1242454.
doi:10.1126/science.1242454
- Zhang M, Jin X, Sun R, et al. Optimization of metabolism to improve efficacy during CAR-T cell manufacturing.J Transl Med. 2021;19(1):499.
doi:10.1186/s12967-021-03165-x
- Raynor JL, Chapman NM, Chi H. Metabolic Control of Memory T-Cell Generation and Stemness. Cold Spring Harb Perspect Biol. 2021;13(6):a037770.
doi:10.1101/cshperspect.a037770
- Franco F, Jaccard A, Romero P, Yu YR, Ho PC. Metabolic and epigenetic regulation of T-cell exhaustion. NatMetab. 2020;2(10):1001-1012.
doi:10.1038/s42255-020-00280-9
- Sugiura A, Rathmell JC. Metabolic Barriers to T Cell Function in Tumors. J Immunol. 2018;200(2):400-407.
doi:10.4049/jimmunol.1701041
- Rangel Rivera GO, Knochelmann HM, Dwyer CJ, et al. Fundamentals of T Cell Metabolism and Strategies to Enhance Cancer Immunotherapy. Front Immunol. 2021;12:645242.
doi:10.3389/fimmu.2021.645242
- Luby A, Alves-Guerra MC. Targeting Metabolism to Control Immune Responses in Cancer and Improve Checkpoint Blockade Immunotherapy. Cancers (Basel). 2021;13(23):5912.
doi:10.3390/cancers13235912
- Kawalekar OU, O’Connor RS, Fraietta JA, et al. Distinct Signaling of Coreceptors Regulates Specific Metabolism Pathways and Impacts Memory Development in CAR T Cells [published correction appears in Immunity. 2016 Mar 15;44(3):712]. Immunity. 2016;44(2):380-390.
doi:10.1016/j.immuni.2016.01.021
- Zheng JB, Wong CW, Liu J, et al. Glucose metabolism inhibitor PFK-015 combined with immune checkpoint
inhibitor is an effective treatment regimen in cancer. Oncoimmunology. 2022;11(1):2079182.
doi:10.10 80/2162402X.2022.2079182
- Rial Saborido J, Völkl S, Aigner M, Mackensen A, Mougiakakos D. Role of CAR T Cell Metabolism for Therapeutic Efficacy. Cancers (Basel). 2022;14(21):5442.
doi:10.3390/cancers14215442
- Li W, Zhang L. Rewiring Mitochondrial Metabolism for CD8+ T Cell Memory Formation and Effective Cancer Immunotherapy. Front Immunol. 2020;11:1834.
doi:10.3389/fimmu.2020.01834
- Xiao X, Wang Y, Zou Z, et al. Combination strategies to optimize the efficacy of chimeric antigen receptor T cell
therapy in haematological malignancies. Front Immunol.2022;13:954235.
doi:10.3389/fimmu.2022.954235
- Wang S, Sellner L, Wang L, et al. Combining selective inhibitors of nuclear export (SINEs) with chimeric antigen receptor (CAR) T cells for CD19positive malignancies. Oncol Rep. 2021;46(2):170.
doi:10.3892/or.2021.8121
- Ramello MC, Haura EB, Abate-Daga D. CAR-T cells and combination therapies: What’s next in the immunotherapy revolution?. Pharmacol Res. 2018;129:194-203.
doi:10.1016/j.phrs.2017.11.035
- Wang AX, Ong XJ, D’Souza C, Neeson PJ, Zhu JJ. Combining chemotherapy with CAR-T cell therapy in treating solid tumors. Front Immunol. 2023;14:1140541.
doi:10.3389/fimmu.2023.1140541
- Liu J, Chen Z, Li Y, Zhao W, Wu J, Zhang Z. PD-1/PD-L1 Checkpoint Inhibitors in Tumor Immunotherapy. Front Pharmacol. 2021;12:731798.
doi:10.3389/fphar.2021.731798
- Harrison D, Wu D, Huang J, Fang Y. Single-cell lactate production rate as a measure of glycolysis in endothelial cells. STAR Protoc. 2021;2(3):100807.
doi:10.1016/j. xpro.2021.100807
- Li X, Yang Y, Zhang B, et al. Lactate metabolism in human health and disease [published correction appears in Signal Transduct Target Ther. 2022 Oct 31;7(1):372]. Signal Transduct Target Ther. 2022;7(1):305.
doi:10.1038/s41392-022-01151-3
- In-Line monitoring of culture medium using Live cell metabolic analyzer. PHC Corporation. https://pages.services/markitbiomedical.com/live-cell-in-line/. Accessed November 02, 2023.
- Patsoukis N, Bardhan K, Chatterjee P, et al. PD-1 alters T-cell metabolic reprogramming by inhibiting glycolysis and promoting lipolysis and fatty acid oxidation. Nat Commun. 2015;6:6692.
doi:10.1038/ncomms7692
- Metabolic rate monitoring of undifferentiated iPS cells and expression analysis of differentiation markers. PHC Corporation. https://www.phchd.com/jp/-/media/biomedical/asia-pacific/jp/landing_page/live-cell/LiveCell_WP03_en.pdf. Accessed December 07, 2023.